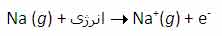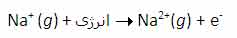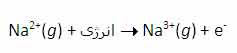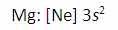|
شیمی 2 و 3 همه چیز در مورد شیمی 2 و 3 آخرین مطالب
آرشيو وبلاگ نويسندگان دو شنبه 15 اسفند 1390برچسب:, :: 15:16 :: نويسنده : milad.danesh
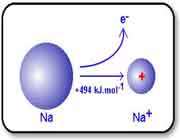
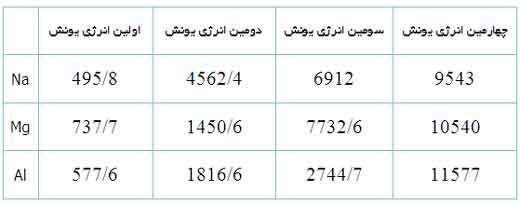
با اندکی مطالعه راجع به انرژی یونش و تشکیل یون های مختلف عناصر، متوجه می شوید که سدیم، منیزیم و آلومینیوم یون های Na+ و Mg2+ و Al3+ تشکیل می دهند. اما آیا تا کنون از خود پرسیده اید که چرا سدیم، یون های Na2+ یا حتی Na3+ تشکیل نمی دهد؟ جواب این سؤال می تواند از انرژی دومین، سومین و ... یونش عناصر به دست آید. به عنوان مثال، انرژی اولین یونش سدیم، انرژی لازم برای برداشتن یک الکترون از یک اتم سدیم خنثی است: انرژی دومین یونش سدیم، انرژی لازم برای برداشتن یک الکترون دیگر از یون Na+ در حالت گازی است که یک یونNa2+تشکیل می دهد: سومین انرژی یونش سدیم نیز به همین ترتیب است: بنابراین انرژی لازم برای تشکیل یون Na3+ در فاز گازی، جمع انرژی های یونش اول، دوم و سوم این عنصر است. برای کندن یک الکترون از اتم سدیم و تشکیل یون Na+ با آرایش الکترونی لایه پر، انرژی چندان زیادی لازم نیست اما وقتی یک بار این اتفاق افتاد، برای برداشتن دومین الکترون از سدیم تقریباً باید 10 برابر انرژی یونش اولیه، انرژی صرف شود تا آرایش لایه پر Na+ شکسته شود و Na2+ تشکیل شود. به دلیل این که انرژی زیادی برای برداشتن دومین الکترون سدیم در هر واکنش شیمیایی لازم است، سدیم می تواند با عناصر دیگر طوری واکنش دهد که ترکیباتی شامل یون های Na+ تشکیل دهد نه یون های Na2+ یا Na3+. به دلیل این منیزیوم، یک پروتون بیش تر از سدیم دارد، اولین انرژی یونش آن بیش تر است تا الکترون ها در اوربیتال 3s نگه دارد: دومین انرژی یونش منیزیوم بزرگ تر از انرژی اولین یونش آن است زیرا همیشه برداشتن یک الکترون از یونی با بار مثبت، انرژی بیش تری می گیرد تا بخواهیم همین اکترون را از یک اتم خنثی برداریم. سومین انرژی یونش منیزیوم خیلی زیاد است زیرا Mg2+ آرایش پایدار و لایه پر دارد. همین وضعیت راجع به آلومینیوم وجود دارد که اولین انرژی یونش آن از منیزیوم کم تر است. انرژی دومین و سومین یونش آلومینیوم از انرژی اولین یونش آن بزرگ تر است. اگرچه برداشتن سه الکترون از اتم آلومینیوم برای تشکیل یون Al3+مقدار انرژی زیادی لازم دارد اما انرژی لازم برای شکستن آرایش الکترونی پایدار یونAl3+ یک مقدار نجومی و عظیم است! بنابراین اشتباه است که به دنبال یون Al4+ به عنوان محصول یک واکنش شیمیایی باشیم. 
نظرات شما عزیزان: پيوندها
|
|||
|
|